Молекулярная геометрия
Молекулярная геометрия или молекулярная структура — это трехмерное расположение атомов, составляющих молекулу. Каждая молекула имеет фиксированную «равновесную геометрию», состоящую из длин связей и углов, вокруг которой атомы непрерывно колеблются посредством колебательных и вращательных движений. Геометрия может быть выведена путем спектроскопических исследований соединения или предсказана с помощью теории валентных связей. Геометрия молекулы зависит от нескольких факторов, таких как то, как атомы связываются вместе и типы химических связей. Свойства молекулы, особенно ее реакционная способность, во многом определяются ее молекулярной геометрией.
Два (или более) вещества могут состоять из молекул, имеющих одну и ту же молекулярную формулу, но с разными молекулярными структурами. Тогда эти вещества будут иметь другие свойства и будут называться изомеры. Например, н-бутан и изобутан являются структурными изомерами, каждый из которых содержит четыре атома углерода и десять атомов водорода. В н-бутане четыре атома углерода расположены в виде прямой цепи, а в изобутане — в виде разветвленной цепи.
Молекулярные модели
Чтобы визуализировать, как молекулы выглядят в трех измерениях, химики используют молекулярные модели. Чаще всего используются модели, известные как «шаровые» и «заполняющие пространство» модели, обычно сделанные из дерева или пластика.
В модели с мячом и клюшкой шары разных цветов используются для обозначения атомов разных элементов. Шарики обычно имеют одинаковый размер, за исключением тех, которые представляют собой атомы водорода, которые меньше. Палки (или пружины) используются для обозначения химических связей между атомами, и они также показывают углы между связями (так называемые «углы связи»). Однако палочки часто демонстрируют химические связи увеличенной длины.
В моделях, заполняющих пространство, для представления атомов используются усеченные шары.Шарики прикреплены друг к другу с помощью защелок, поэтому химические связи не видны. Размеры шаров пропорциональны размерам атомов (атомным радиусам).
Уровни энергии
В символ молекулярного термина сокращенное выражение угловых моментов, которые характеризуют электронные квантовые состояния двухатомной молекулы, которые также являются собственные состояния электронного молекулярного Гамильтониан. Также удобно и распространено представление двухатомной молекулы в виде двухточечных масс, соединенных безмассовой пружиной. Затем энергии, участвующие в различных движениях молекулы, можно разделить на три категории: поступательные, вращательные и колебательные энергии.
Трансляционные энергии
Поступательная энергия молекулы определяется выражением кинетическая энергия выражение:
- Eтранс=12мv2{ displaystyle E _ { text {trans}} = { frac {1} {2}} mv ^ {2}}
куда м{ displaystyle m} — масса молекулы и v{ displaystyle v} это его скорость.
Вращательные энергии
Классически кинетическая энергия вращения равна
-
- Eгнить=L22я{ displaystyle E _ { text {rot}} = { frac {L ^ {2}} {2I}} ,}
- куда
- L{ Displaystyle L ,} это угловой момент
- я{ Displaystyle I ,} это момент инерции молекулы
Для микроскопических систем атомного уровня, таких как молекула, угловой момент может иметь только определенные дискретные значения, заданные формулой
-
- L2=ℓ(ℓ+1)ℏ2{ Displaystyle L ^ {2} = ell ( ell +1) hbar ^ {2} ,}
- куда ℓ{ displaystyle ell} является целым неотрицательным числом и ℏ{ displaystyle hbar} это приведенная постоянная Планка.
Кроме того, для двухатомной молекулы момент инерции равен
-
- я=μр2{ displaystyle I = mu r_ {0} ^ {2} ,}
- куда
- μ{ displaystyle mu ,} это уменьшенная масса молекулы и
- р{ displaystyle r_ {0} ,} — среднее расстояние между центрами двух атомов в молекуле.
Итак, подставляя угловой момент и момент инерции в Eгнить, уровни вращательной энергии двухатомной молекулы определяются выражением:
-
- Eгнить=л(л+1)ℏ22μр2 л=,1,2,…{ displaystyle E _ { text {rot}} = { frac {l (l + 1) hbar ^ {2}} {2 mu r_ {0} ^ {2}}} l = 0,1,2, … ,}
Колебательные энергии
Другой тип движения двухатомной молекулы — это колебание каждого атома или вибрировать — вдоль линии, соединяющей два атома. Колебательная энергия примерно равна энергии вибрации. квантовый гармонический осциллятор:
-
- Eвиб=(п+12)ℏω п=,1,2,….{ displaystyle E _ { text {vib}} = left (n + { frac {1} {2}} right) hbar omega n = 0,1,2, …. ,}
- куда
- п{ displaystyle n} это целое число
- ℏ{ displaystyle hbar} это приведенная постоянная Планка и
- ω{ displaystyle omega} это угловая частота вибрации.
Сравнение интервалов вращательной и колебательной энергии
Расстояние и энергия типичного спектроскопического перехода между уровнями колебательной энергии примерно в 100 раз больше, чем у типичного перехода между уровнями энергии. вращательная энергия уровни.
Уровни энергии
В символ молекулярного термина сокращенное выражение угловых моментов, которые характеризуют электронные квантовые состояния двухатомной молекулы, которые также являются собственные состояния электронного молекулярного Гамильтониан. Также удобно и распространено представление двухатомной молекулы в виде двухточечных масс, соединенных безмассовой пружиной. Затем энергии, участвующие в различных движениях молекулы, можно разделить на три категории: поступательные, вращательные и колебательные энергии.
Трансляционные энергии
Поступательная энергия молекулы определяется выражением кинетическая энергия выражение:
- Eтранс=12мv2{ displaystyle E _ { text {trans}} = { frac {1} {2}} mv ^ {2}}
куда м{ displaystyle m} — масса молекулы и v{ displaystyle v} это его скорость.
Вращательные энергии
Классически кинетическая энергия вращения равна
-
- Eгнить=L22я{ displaystyle E _ { text {rot}} = { frac {L ^ {2}} {2I}} ,}
- куда
- L{ Displaystyle L ,} это угловой момент
- я{ Displaystyle I ,} это момент инерции молекулы
Для микроскопических систем атомного уровня, таких как молекула, угловой момент может иметь только определенные дискретные значения, заданные формулой
-
- L2=ℓ(ℓ+1)ℏ2{ Displaystyle L ^ {2} = ell ( ell +1) hbar ^ {2} ,}
- куда ℓ{ displaystyle ell} является целым неотрицательным числом и ℏ{ displaystyle hbar} это приведенная постоянная Планка.
Кроме того, для двухатомной молекулы момент инерции равен
-
- я=μр2{ displaystyle I = mu r_ {0} ^ {2} ,}
- куда
- μ{ displaystyle mu ,} это уменьшенная масса молекулы и
- р{ displaystyle r_ {0} ,} — среднее расстояние между центрами двух атомов в молекуле.
Итак, подставляя угловой момент и момент инерции в Eгнить, уровни вращательной энергии двухатомной молекулы определяются выражением:
-
- Eгнить=л(л+1)ℏ22μр2 л=,1,2,…{ displaystyle E _ { text {rot}} = { frac {l (l + 1) hbar ^ {2}} {2 mu r_ {0} ^ {2}}} l = 0,1,2, … ,}
Колебательные энергии
Другой тип движения двухатомной молекулы — это колебание каждого атома или вибрировать — вдоль линии, соединяющей два атома. Колебательная энергия примерно равна энергии вибрации. квантовый гармонический осциллятор:
-
- Eвиб=(п+12)ℏω п=,1,2,….{ displaystyle E _ { text {vib}} = left (n + { frac {1} {2}} right) hbar omega n = 0,1,2, …. ,}
- куда
- п{ displaystyle n} это целое число
- ℏ{ displaystyle hbar} это приведенная постоянная Планка и
- ω{ displaystyle omega} это угловая частота вибрации.
Сравнение интервалов вращательной и колебательной энергии
Расстояние и энергия типичного спектроскопического перехода между уровнями колебательной энергии примерно в 100 раз больше, чем у типичного перехода между уровнями энергии. вращательная энергия уровни.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
Алмаз — атомы углерода находятся в вершинах воображаемых тетраэдров;
Графит — атомы углерода находятся в одной плоскости;
Карбин — атомы углерода образуют «нити».
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях. Зная валентности атома или группы атомов можно составить формулу соединения
Для этого пользуются правилами:
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Если валентности одинаковы, то и число атомов одинаково, т. е. индексы не ставим:
Если валентности кратны (одно число делится на другое), то число атомов элемента с меньшей валентностью определяем делением:
В остальных случаях индексы определяют «крест-накрест»:
Задание 1.4. Составьте химические формулы соединений:
Свойства двухатомных молекул
Важной характеристикой двухатомных молекул является кривая потенциальной энергии. При сближении двух атомов друг к другу возникает химическая связь, что отражается на потенциальной энергии
При образовании связи на кривой появляется минимум, характеризующий равновесное расстояние (re) между ядрами. Если химическая связь не образуется, то минимум на потенциальной кривой не появляется, хотя атомы взаимодействуют между собой.
Электронное состояние молекулы – это совокупность электронных состояний атомов. Движение электронов происходит в молекулярных пределах. При рассмотрении необходимо учитывать то, что некоторые электроны принадлежат молекуле, а некоторые – отдельным атомам
Это разделение важно брать во внимание при образовании ионных и ковалентных связей. В первом случае атомы с большей электроотрицательностью отдают свои электроны другим атомам. Таким образом формируются ионы с заполненными оболочками, между которыми действуют электростатические силы притяжения
Например, ионная связь образуется в молекуле поваренной соли NaCl.
Таким образом формируются ионы с заполненными оболочками, между которыми действуют электростатические силы притяжения. Например, ионная связь образуется в молекуле поваренной соли NaCl.
Ионная и ковалентная связи – предельные случаи, которые могут действовать с большей или меньшей степенью точности. Есть предположение, что существуют промежуточные связи с различными степенями ковалентности и ионности. Координационные, водородные и ван-дер-ваальсовские связи обладают меньшей прочностью. Последние возникают благодаря взаимной поляризации молекул.
Что такое молекула в химии
Учение о молекулах для химической науки является одним из самых главных. Именно химические исследования дали важнейшие сведения о составе и свойствах этой мельчайшей единицы вещества.
При прохождении химического превращения молекулы обмениваются атомами, распадаются. Поэтому знания о строении и состоянии этих частиц лежат в основе изучения химии веществ и их превращений.
На основании знаний о проходящей химической реакции можно предсказать строение молекул веществ, в ней участвующих. Противоположное заключение тоже будет верным: на основании сведений о строении молекулы вещества реально предсказать его поведение во время химической реакции.
Молекулярная спектроскопия
- Основная статья: Спектроскопия
Молекулярная спектроскопия это технология, которая чрезвычайно полезна для определения структурных особенностей молекул вещества. На образец вещества воздействуют зондирующим сигналом, которым может быть электромагнитное излучение или пучок электронов или других элементарных частиц с известным уровнем энергии. Молекулы могут реагировать по-разному: (а) поглощая излучение (спектроскопия поглощения); (б) излучением другого сигнала (эмиссионная спектроскопия); (в) фрагментацией; или (d) химическими изменениями.
Анализируя спектр энергии, которая поглощается или испускается молекулами, или выделяемые фрагменты, или производимые химические изменения, ученые могут определять состав и молекулярную структуру веществ. Чтобы извлечь максимум информации о веществе, спектроскопия часто сочетается с химическим анализом и вычислениями.
Возбужденные электронные состояния
Двухатомные молекулы обычно находятся в самом низком или основном состоянии, которое обычно также называют Икс{ displaystyle X} государственный. Когда газ из двухатомных молекул бомбардируется энергичными электронами, некоторые молекулы могут быть возбуждены до более высоких электронных состояний, как это происходит, например, в естественном полярном сиянии; ядерные взрывы на большой высоте; и эксперименты с ракетной электронной пушкой. Такое возбуждение может также происходить, когда газ поглощает свет или другое электромагнитное излучение. Возбужденные состояния нестабильны и естественным образом возвращаются в основное состояние. В течение различных коротких периодов времени после возбуждения (обычно доли секунды, а иногда и дольше секунды, если возбужденное состояние метастабильный ) переходы происходят из более высоких электронных состояний в более низкие и, в конечном итоге, в основное состояние, и в каждом переходе возникает фотон испускается. Это излучение известно как флуоресценция. Последовательно более высокие электронные состояния принято называть А{ displaystyle A}, B{ displaystyle B}, C{ displaystyle C}и т. д. (но это соглашение не всегда соблюдается, и иногда используются строчные буквы и буквы в алфавитном порядке, не расположенные по порядку, как в примере, приведенном ниже). Энергия возбуждения должна быть больше или равна энергии электронного состояния, чтобы возбуждение произошло.
В квантовой теории электронное состояние двухатомной молекулы представлено символ молекулярного термина
- 2S+1Λ(v){ Displaystyle ^ {2S + 1} Lambda (v)}
куда S{ displaystyle S} — полное квантовое число электронного спина, Λ{ displaystyle Lambda} — квантовое число полного электронного углового момента вдоль межъядерной оси, а v{ displaystyle v} — колебательное квантовое число. Λ{ displaystyle Lambda} принимает значения 0, 1, 2, …, которые представлены электронными символами состояния Σ{ displaystyle Sigma}, Π{ displaystyle Pi}, Δ{ displaystyle Delta}, …. Например, в следующей таблице перечислены общие электронные состояния (без колебательных квантовых чисел) вместе с энергией самого нижнего колебательного уровня (v={ displaystyle v = 0}) двухатомного азота (N2), самый распространенный газ в атмосфере Земли. В таблице нижние и верхние индексы после Λ{ displaystyle Lambda} дать дополнительные квантово-механические детали об электронном состоянии.
| Состояние | Энергия (Т{ displaystyle T_ {0}}, см−1) |
|---|---|
| Икс1Σграмм+{ Displaystyle X ^ {1} Sigma _ {g} ^ {+}} | 0.0 |
| А3Σты+{ displaystyle A ^ {3} Sigma _ {u} ^ {+}} | 49754.8 |
| B3Πграмм{ displaystyle B ^ {3} Pi _ {g}} | 59306.8 |
| W3Δты{ Displaystyle W ^ {3} Delta _ {u}} | 59380.2 |
| B′3Σты−{ displaystyle B ‘^ {3} Sigma _ {u} ^ {-}} | 65851.3 |
| а′1Σты−{ displaystyle a ‘^ {1} Sigma _ {u} ^ {-}} | 67739.3 |
| а1Πграмм{ displaystyle a ^ {1} Pi _ {g}} | 68951.2 |
| ш1Δты{ displaystyle w ^ {1} Delta _ {u}} | 71698.4 |
- Единицы «энергии» здесь на самом деле являются обратной величиной длины волны фотона, испускаемого при переходе в состояние с наименьшей энергией. Фактическая энергия может быть найдена путем умножения данной статистики на произведение c (скорость света) и час (Постоянная Планка); т.е. примерно 1,99 × 10−25 Джоуль-метры, а затем умножение на 100, чтобы преобразовать из см−1 к м−1.
Вышеупомянутое флуоресценция встречается в разных регионах электромагнитный спектр, называется «полосы излучения «: каждая полоса соответствует определенному переходу от более высокого электронного состояния и колебательного уровня к более низкому электронному состоянию и колебательному уровню (обычно в возбужденном газе, состоящем из двухатомных молекул, задействовано множество колебательных уровней). Например, N2А{ displaystyle A}-Икс{ displaystyle X} полосы излучения (также известные как полосы Вегарда-Каплана) присутствуют в спектральном диапазоне от 0,14 до 1,45 мкм (микрометров). Данная полоса может быть распределена на несколько нанометров в электромагнитном пространстве длин волн из-за различных переходов, которые происходят во вращательном квантовом числе молекулы, J{ displaystyle J}. Они подразделяются на отдельные ветви поддиапазонов, в зависимости от изменения в J{ displaystyle J}. В р{ displaystyle R} ветвь соответствует ΔJ=+1{ Displaystyle Delta J = + 1}, то п{ displaystyle P} ветвь к ΔJ=−1{ displaystyle Delta J = -1}, а Q{ displaystyle Q} ветвь к ΔJ={ displaystyle Delta J = 0}. Группы еще больше расширяются за счет ограниченного спектральное разрешение из спектрометр который используется для измерения спектр. Спектральное разрешение зависит от прибора. функция разброса точки.
Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
- свежее молоко стало кислым;
- зелёные листья стали жёлтыми;
- сырое мясо при обжаривании изменило запах.
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
- обязательно изменяется состав или строение молекул;
- никогда не изменяется состав и заряд ядер атомов.
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
- Н2О — вода;
- Na8[(AlSiO4)6SO4] — лазурит.
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na+ и ионов Cl– (условная «молекула» — NaСl).
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
- Н — атом водорода;
- О — атом кислорода.
Число атомов в молекуле обозначают при помощи индекса:
Примеры:
- О2 — это молекула вещества кислорода, состоящая из двух атомов кислорода;
- Н2О — это молекула вещества воды, состоящая из двух атомов водорода и одного атома кислорода.
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:
Аналогично изображают число молекул:
- 2Н2 — две молекулы водорода;
- 3Н2О — три молекулы воды.
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
Вопрос. А чем отличаются химические формулы веществ:
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.
Гомоядерные молекулы
Гомоядерная двухатомная молекула – это молекула , состоящая из двух равных атомов .
Некоторые элементы таблицы Менделеева имеют стандартное состояние в виде двухатомной молекулы, как в случае водорода (H 2 ), азота (N 2 ), кислорода (O 2 ), фтора (F 2 ), хлора (Cl 2 ), бром (Br 2 ) и йод (I 2 ). Фосфор (P 4 ) и Сера (S 8 )
не являются двухатомными
Молекула H 2 +
Молекулярная связывающая орбиталь.
Молекулярная орбиталь антисвязывающего агента.
Гомоядерные двухатомные молекулы состоят из двух атомов одного и того же химического элемента; простейшим из них является H 2 + , для которого электронное уравнение принимает вид:
где второй и третий члены представляют V ne притяжение электрона к ядрам, а четвертый — отталкивание двух ядер.
Два протона образуют две потенциальные ямы, а волновая функция электрона представляет собой линейную комбинацию двух водородоподобных волновых функций
Волновая функция образует связывающую молекулярную орбиталь , функция образует разрыхляющую орбиталь . Связывающая орбиталь имеет меньшую энергию, чем разрыхляющая орбиталь, и поэтому является наиболее вероятной.
Функции , хотя и хорошо описывают распределение вероятностей электрона в основном состоянии, не являются точными решениями электронного уравнения.
Волновая функция в пространстве между двумя ядрами больше, чем отдельные водородоподобные волновые функции , и именно этот факт создает ковалентную связь между двумя ядрами. Фактически отмечается, что плотность вероятности связана с волновой функцией:
он содержит член взаимодействия, двойное произведение, которое представляет собой суперпозицию двух волновых функций: это область отрицательного заряда, которая объединяет два ядра с противоположным зарядом.
Что касается разрыхляющей орбитали , то она исчезает посередине между двумя ядрами, где она создает более низкую плотность вероятности, чем она была бы без члена суперпозиции.
Молекула H 2
Связующая орбиталь H 2.H 2 антисвязывающая орбиталь .
Теперь рассмотрим молекулу H 2 , простейшую нейтральную молекулу. Имея два электрона, волновая функция синглетного электрона определяется выражением:
и представляет собой орбиталь связи, а триплет из:
представляющий разрыхляющую орбиталь, где:
А также
являются спиновыми состояниями , где + представляет спин вверх, — спин вниз.
Пространственная плотность вероятности:
Также в этом случае интерференционный член представляет собой суперпозицию водородоподобных волновых функций в области между ядрами и включает увеличение заряда в случае синглета (знак +) и уменьшение заряда в случае триплета (-). знак).
Гомоядерные двухатомные молекулы первого и второго периода
Широко изучены гомоядерные двухатомные молекулы первого и второго периода (H-Ne).
Все они являются диамагнитными молекулами (S = 0), за исключением B 2 и O 2 , которые являются парамагнитными (S = 1). в приведенной ниже таблице показаны член основного состояния, значение энергии диссоциации (D e ) и равновесное расстояние (Re ) для каждой молекулы.
Молекулярные орбитали, которые последовательно заполняются, получаются подходящими линейными комбинациями атомных орбиталей типа 1s и 2s ( σg 1s/ 2s и σu * 1s/2s), 2px и 2py (πu и πg * ) и 2pz (σ g 2p и σ u * 2p).
| Молекула | Основной государственный термин | D е (эВ) | Р и (А) |
|---|---|---|---|
| Н 2 | 1 Σ + г | 4,52 | 0,74 |
| Он 2 | 1 Σ + г | 0,0009 | 3.00 |
| Ли 2 | 1 Σ + г | 1.07 | 2,67 |
| Будь 2 | 1 Σ + г | 0,10 | 2,45 |
| Б 2 | 3 Σ — г | 3.1 | 1,59 |
| С 2 | 1 Σ + г | 6.3 | 1,24 |
| № 2 | 1 Σ + г | 9,92 | 1.10 |
| ИЛИ 2 | 3 Σ — г | 5.21 | 1,21 |
| Ф 2 | 1 Σ + г | 1,66 | 1,41 |
| Не 2 | 1 Σ + г | 0,0036 | 3.1 |
Гомоядерные двухатомные молекулы третьего периода (Na-Cl)
Двухатомные молекулы третьего периода были экспериментально охарактеризованы на спектроскопическом уровне. Cl 2 является стандартным состоянием для элементарного хлора.
| Молекула | Основной государственный термин | D е (эВ) | Р и (А) |
|---|---|---|---|
| На 2 | 3.0788 | ||
| мг 2 | 3890 | ||
| В 2 | 2466 | ||
| Да 2 | 2,246 | ||
| Р 2 | 1893 | ||
| С 2 | 1889 | ||
| Кл 2 | 1,987 |
Гетероядерная двухатомная молекула плавиковой кислоты .
См. также
Wikimedia Foundation . 2010 .
Смотреть что такое «Двухатомная молекула» в других словарях:
двухатомная молекула — dviatomė molekulė statusas T sritis fizika atitikmenys: angl. diatomic molecule; two atom molecule vok. zweiatomiges Molekül, n rus. двухатомная молекула, f pranc. molécule diatomique, f … Fizikos terminų žodynas
Химическая связь — … Википедия
двуха́томный — ая, ое. Состоящий из двух атомов. Двухатомное соединение. Двухатомная молекула … Малый академический словарь
Абсолютно твёрдое тело — Абсолютно твёрдое тело второй опорный объект механики наряду с материальной точкой. Механика абсолютно твердого тела полностью сводима к механике материальных точек (с наложенными связями), но имеет собственное содержание (полезные понятия… … Википедия
Абсолютно твердое тело — Абсолютно твёрдое тело в механике механическая система, обладающая только поступательными и вращательными степенями свободы. «Твёрдость» означает, что тело не может быть деформировано, то есть телу нельзя передать никакой другой энергии, кроме… … Википедия
Молекулярный ион водорода — Молекулярный ион водорода простейшая двухатомная молекула H2+, образуется при ионизации молекулы водорода. В молекулярном ионе H2+ образуется одноэлектронная химическая связь с расстоянием dHH = 1,07Å. Одноэлектронная связь менее прочна… … Википедия
Межатомное взаимодействие — Вид вращающегося фуллерена C60. Межатомное воздействие электромагнитное взаимодействие электронов и ядра одного атома с электронами и ядром другого атома. Межато … Википедия
diatomic molecule — dviatomė molekulė statusas T sritis fizika atitikmenys: angl. diatomic molecule; two atom molecule vok. zweiatomiges Molekül, n rus. двухатомная молекула, f pranc. molécule diatomique, f … Fizikos terminų žodynas
dviatomė molekulė — statusas T sritis fizika atitikmenys: angl. diatomic molecule; two atom molecule vok. zweiatomiges Molekül, n rus. двухатомная молекула, f pranc. molécule diatomique, f … Fizikos terminų žodynas
molécule diatomique — dviatomė molekulė statusas T sritis fizika atitikmenys: angl. diatomic molecule; two atom molecule vok. zweiatomiges Molekül, n rus. двухатомная молекула, f pranc. molécule diatomique, f … Fizikos terminų žodynas
Источник
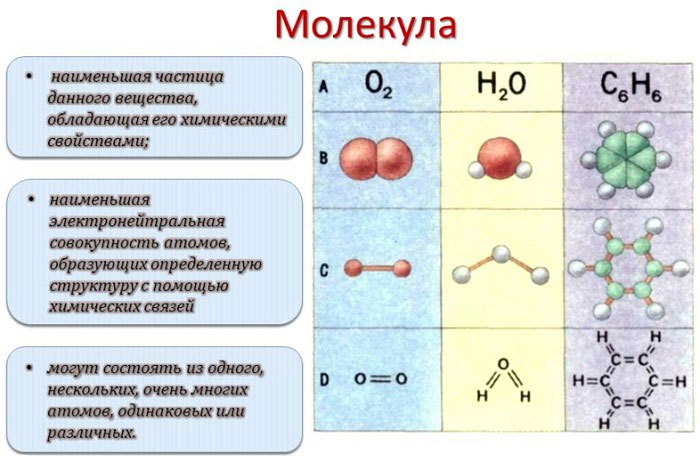
Диаграммы энергетических уровней двухатомных молекул
Для ряда простых двухатомных молекул можно использовать схему энергетических уровней, приведенную на рис. 3. Так, например, молекула азота, у которой 10 валентных электронов, имеет следующую конфигурацию:
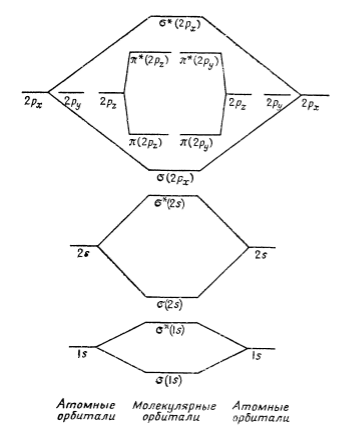 Рисунок 3. Упрощенная качественная диаграмма энергетических уровней для двухатомной молекулы, например, $N_2$
Рисунок 3. Упрощенная качественная диаграмма энергетических уровней для двухатомной молекулы, например, $N_2$
Поскольку участие $2δs$-электронов в образовании связи исключено присутствием двух электронов на разрыхляющей $δ^*$-орбитали, то эти две орбитали фактически эквивалентны двум несвязывающим парам электронов у каждого атома азота. В сумме получаем три связывающие пары электронов, т. е. возникает тройная связь. В молекуле кислорода добавляется еще два электрона, которые, очевидно, должны заселить пару вырожденных $δ^*$-орбиталей $2р$. Согласно правилу Гунда, электроны будут располагаться по одному на каждой орбитали и будут неспаренными. Это послужило объяснением парамагнетизма молекулы $O_2$ (рис. 4) и явилось одним из первых успехов метода молекулярных орбиталей. Таким образом, в молекуле кислорода кроме несвязывающих $2s$-электронов имеются еще три поделенные пары и два неспаренных разрыхляющих электрона.
Энергетическая схема $O_2$
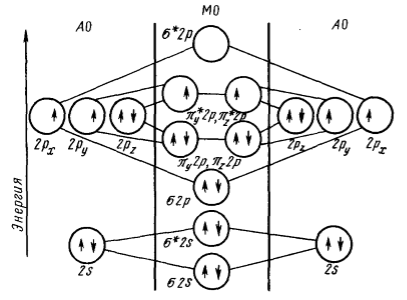 Рисунок 4. Энергетическая схема $АО$ и $МО$ в системе из двух атомов кислорода
Рисунок 4. Энергетическая схема $АО$ и $МО$ в системе из двух атомов кислорода
Однако соотношение уровней энергий $МО$ может измениться даже в одном и том же периоде из-за взаимодействия электронов $МО$, у которых разница энергий не очень велика (рис. 5).
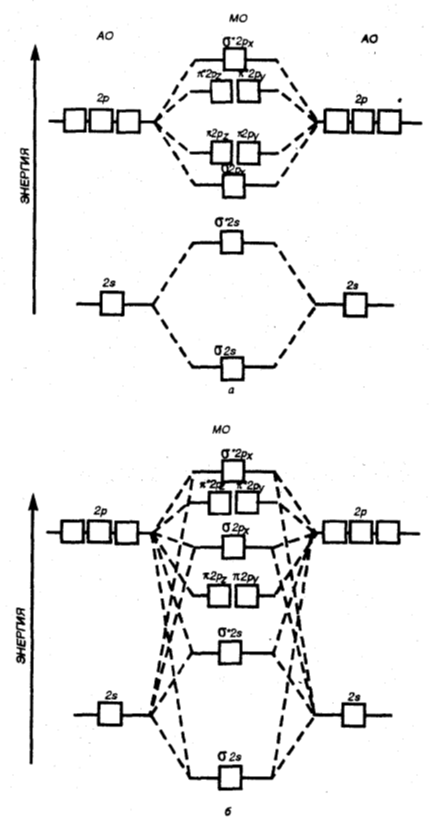 Рисунок 5. Диаграмма энергетических уровней $АО$ и $МО$ двугомоядерных молекул элементов от начала (до $N_2$) (а) и до конца (от $N_2$ до $F_2$) (б) второго периода
Рисунок 5. Диаграмма энергетических уровней $АО$ и $МО$ двугомоядерных молекул элементов от начала (до $N_2$) (а) и до конца (от $N_2$ до $F_2$) (б) второго периода
Представители
В зависимости от строения выделяют двухатомные, трёхатомные, четырёхатомные и т.д. спирты. Они отличаются на одну гидроксильную группу -ОН. Общую формулу многоатомных спиртов можно записать как CnH2n+2(OH)n. Однако количество атомов углерода не всегда соответствует количеству гидроксильных групп. Такое несоответствие объясняется разной структурой углеродного скелета. Например, пентаэритрит содержит пять атомов углерода и четыре группы -ОН (один углерод посередине), а сорбит – по шесть атомов углерода и групп -ОН.
Рис. 1. Структурные формулы пентаэритрита и сорбита.
В таблице описаны наиболее известные представители полиолов.
|
Вид спирта |
Название |
Формула |
Физические свойства |
|
Двухатомные (диолы) |
Этиленгликоль |
HO-CH2-CH2-OH |
Прозрачная маслянистая сильно токсичная жидкость без запаха, со сладким привкусом |
|
Трёхатомные (триолы) |
Глицерин |
C3H5(OH)3 |
Вязкая прозрачная жидкость. Смешивается с водой в любых пропорциях. Имеет сладкий вкус |
|
Четырёхатомные |
Пентаэритрит |
C(CH2OH)4 |
Кристаллический белый порошок со сладким вкусом. Растворяется в воде и органических растворителях |
|
Пятиатомные |
Ксилит |
CH2OH(CHOH)3CH2OH |
Кристаллическое бесцветное вещество сладкое на вкус. Хорошо растворяется в воде, спиртах, органических кислотах |
|
Шестиатомные |
Сорбит (глюцит) |
C6H8(HO)6 |
Сладкое кристаллическое вещество, хорошо растворимое в воде, но плохо растворимое в этаноле |
Некоторые кристаллические многоатомные спирты, например, ксилит, сорбит, используют в качестве сахарозаменителя и пищевой добавки.
Рис. 2. Ксилит.





























