Содержание
|
||||||||||||||||||||||||||||||||||||||||||
| Общий | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Имя, Символ, Число | фермий, Fm, 100 | |||||||||||||||||||||||||||||||||||||||||
| Химическая серия | актиниды | |||||||||||||||||||||||||||||||||||||||||
| Группа, Период, Блок | н / д, 7, ж | |||||||||||||||||||||||||||||||||||||||||
| Появление | неизвестно, вероятно, серебристыйбелый или серый металлик | |||||||||||||||||||||||||||||||||||||||||
| Атомная масса | (257) г / моль | |||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | 5f12 7 с2 | |||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 18, 32, 30, 8, 2 | |||||||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||||||
| Фаза | твердый | |||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 1800 К(1527 ° С, 2781 ° F) | |||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||||||||||||||||
| Состояния окисления | 2, 3 | |||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | 1,3 (шкала Полинга) | |||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации | 1-я: 627 кДж / моль | |||||||||||||||||||||||||||||||||||||||||
| Разное | ||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер CAS | 7440-72-4 | |||||||||||||||||||||||||||||||||||||||||
| Известные изотопы | ||||||||||||||||||||||||||||||||||||||||||
|
Фермий (химический символ FM, атомный номер 100) является синтетическим элементом периодической таблицы Менделеева. Металлический трансурановый элемент с высокой радиоактивностью. актинидного ряда он образуется при бомбардировке плутония нейтронами. Фермий представляет интерес в основном для фундаментальных исследований, и его приложения еще не разработаны.
Введение[править | править код]
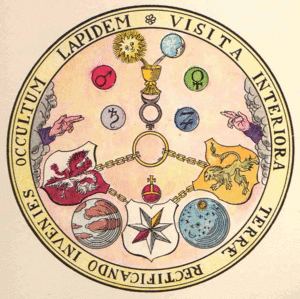
Семь металлов алхимии соответствовали семи небесным светилам: золото — Солнце, серебро — Луна, олово — Юпитер, медь — Венера, свинец — Сатурн, ртуть — Меркурий, железо — Марс (гравюра из алхимического трактата Василия Валентина «Азот», XV век)
В настоящее время известно 118 химических элементов и более 400 простых веществ. Если не принимать в расчёт вещества сложные, то классическая европейская алхимия выделяла семь металлов (золото, серебро, железо, медь, олово, ртуть, свинец), три полуметалла (мышьяк, сурьму и висмут) и три неметалла (серу, углерод, фосфор). В Трактате по элементарной химии (фр. Traité élémentaire de chimie), изданном в 1789 году, основоположник современной химии Антуан Лоран Лавуазье упоминал 17 металлов и полуметаллов, а также 6 неметаллов. В I половине XIX века были открыты некоторые металлы платиновой группы, новые щелочные, щелочноземельные и редкоземельные металлы. В конце XIX века началось исследование радиоактивных элементов. Во II половине XX века были искусственно получены элементы трансурановые.
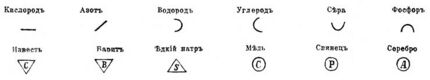
Символы Гассенфратца и Адета
Параллельно развивалась система краткой записи наименований химических элементов. Прежде всего это символика средневековой европейской алхимии, включавшая символические изображения, буквенные сокращения, а также их сочетания, и использовавшаяся для представления веществ, химических операций и приборов. Она сформировалась в XIII веке и просуществовала до конца XVIII века, периода становления химии как науки. В 1787 году французы Жан Гассенфратц и Пьер Адет предложили обозначать химические вещества более простыми знаками и буквами, которые при этом были бы тождественны для близких элементов. Так, все металлы должны были обозначаться кругами с начальной буквой латинского названия металла в середине, щёлочи — треугольниками. В начале XIX века получила распространение система английского химика Джона Дальтона, который ввёл обозначения в виде кружков, внутри которых помещались точки, чёрточки, начальные буквы английских названий элементов. В 1814 году шведский химик Йёнс Берцелиус предложил использовать простые буквенные символы химических элементов, которые и легли в основу современной системы обозначений.
Символ и атомный номер водорода (лат. Hydrogenium)
Современные символы химических элементов состоят из первой буквы или из первой и одной из следующих букв латинского названия элемента (например, H — водород от лат. Hydrogenium, Ca — кальций от лат. Calcium, Rg — рентгений от лат. Roentgenium). Отдельно или слева внизу от символа (1H, 20Ca, 111Rg) для обозначения химических элементов может использоваться атомный номер, он же порядковый номер химического элемента в Периодической системе химических элементов, равный количеству протонов в атомном ядре. Для неоткрытых и новооткрытых трансурановых элементов, которые пока не получили утверждённого Международным союзом теоретической и прикладной химии (ИЮПАК) названия, используют временные трёхбуквенные обозначения, означающие числительное — порядковый номер. Например, Uue — унуненний (лат. Ununennium, 119), Ubh — унбигексий (лат. Unbihexium, 126). Утверждённые ИЮПАК символы являются международными, однако наряду с ними или вместо них в некоторых странах могут использоваться обозначения, произведённые от национальных названий элементов. Например, во Франции вместо международных символов азота (N), бериллия (Be) и вольфрама (W) могут использоваться сокращения Az (от фр. Azote), Gl (фр. Glucinium) и Tu (фр. Tungstène). В США вместо знака ниобия (Nb) может применяться символ Cb (от лат. Columbium). В Китае используется символика, основанная на иероглифах.
Для поиска химических элементов в базах данных или упоминаний в специальной литературе часто используется регистрационный номер CAS или CAS-номер (англ. CAS registry number, CAS number, CAS RN, CAS #). Это уникальный цифровой идентификатор химических элементов, их соединений, полимеров, нуклеотидов, аминокислот, смесей, сплавов, который присваивается всем когда-либо упомянутым в литературе веществам и вносится в реестр Химической реферативной службы (англ. Chemical Abstracts Service). CAS-номер записывается в виде трёх разделённых дефисами чисел, где последнее выполняет функцию контрольного числа (например, водород — 1333-74-0, кальций — 7440-70-2, рентгений — 54386-24-2).
Разрешение на использование
Применение в производстве разрешено в следующих странах: Канаде, США, странах Евросоюза, Белоруссии, России. На территории Украины данных по разрешению использования данной добавки нет.
Важно в период выбора продуктов питания и иных продуктов бытового и лекарственного назначения, обращать внимание на состав, так как некоторые производители все же используют в производстве ферроцианиды натрия. И хоть в умеренных дозировках данный эмульгатор безопасен, рисковать своим здоровьем не рекомендуем, так как Е535 является токсичной добавкой химического происхождения, а, как известно, подобного рода вещества не могут принести пользу организму. Будьте осторожны и выбирайте только безопасные, здоровые и полезные продукты
Будьте осторожны и выбирайте только безопасные, здоровые и полезные продукты.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Будем признательны, если воспользуетесь кнопочками:
Открытие
Фермий впервые был обнаружен в выпадении Айви Майк ядерное испытание.
Элемент назван в честь Энрико Ферми.
Элемент был обнаружен командой во главе с Альберт Гиорсо.
Фермий был впервые обнаружен в осадкахАйви Майк ‘ядерное испытание (1 ноября 1952 г.), первое успешное испытание водородной бомбы. Первоначальное обследование обломков взрыва показало образование нового изотопа плутоний, 24494Пу: это могло образоваться только путем поглощения шести нейтроны по уран-238 ядро, за которым следуют два β− распадается. В то время считалось, что поглощение нейтронов тяжелым ядром — редкий процесс, но идентификация 24494Пу повысил вероятность того, что еще больше нейтронов могло быть поглощено ядрами урана, что привело к появлению новых элементов.
Элемент 99 (эйнштейний ) был быстро обнаружен на фильтровальной бумаге, пролетевшей через облако после взрыва (тот же метод отбора проб, который использовался для обнаружения 24494Пу). Затем он был идентифицирован в декабре 1952 г. Альберт Гиорсо и коллеги по Калифорнийский университет в Беркли. Они открыли изотоп 253Es (период полураспада 20,5 дней), что было сделано захватывать из 15 нейтроны от уран-238 ядра, которые затем претерпели семь последовательных бета-распад:
Немного 238Атомы урана могли захватить другое количество нейтронов (скорее всего, 16 или 17).
Открытие фермия (Z = 100) потребовалось больше материала, так как ожидалось, что урожай будет по крайней мере на порядок ниже, чем у элемента 99, и поэтому зараженные кораллы из Атолл Эниветок (где проводились испытания) был отправлен в Радиационная лаборатория Калифорнийского университета в Беркли, Калифорния, для обработки и анализа. Примерно через два месяца после испытания был изолирован новый компонент, излучающий высокую энергию. α-частицы (7,1 МэВ) с период полураспада около суток. При таком коротком периоде полураспада он мог возникнуть только из-за β− распад изотопа эйнштейния, и поэтому должен был быть изотоп нового элемента 100: он был быстро идентифицирован как 255Fm (т = 20,07 (7) часов).
Открытие новых элементов и новые данные о захвате нейтронов изначально держались в секрете по приказу вооруженных сил США до 1955 года из-за Холодная война напряжение. Тем не менее, команде Беркли удалось подготовить элементы 99 и 100 гражданскими средствами путем нейтронной бомбардировки плутоний-239 и опубликовал эту работу в 1954 году с оговоркой, что это не первые исследования, проведенные на элементах. Исследования «Айви Майк» были рассекречены и опубликованы в 1955 году.
Команда Беркли была обеспокоена тем, что другая группа может открыть более легкие изотопы элемента 100 с помощью методов ионной бомбардировки, прежде чем они смогут опубликовать свое секретное исследование. и это оказалось так. Группа из Нобелевского института физики в Стокгольме независимо открыла этот элемент, создав изотоп позже подтверждено 250Fm (т1/2 = 30 минут), обстреляв 23892U цель с кислород-16 ионы, и опубликовали свою работу в мае 1954 г. Тем не менее приоритет команды Беркли был общепризнан, а вместе с ним и прерогатива назвать новый элемент в честь недавно умершего. Энрико Ферми, разработчик первого искусственного автономного ядерного реактора.
В космической технологии
Fe5 — это высокочастотный конвертер, который используется в космической технологии для преобразования электрических сигналов и передачи данных на большие расстояния
Это особенно важно для космических кораблей и спутников связи, которые находятся на орбите, где передача данных может быть затруднена
Fe5 работает на экстремально высоких частотах, что дает ему возможность обрабатывать большое количество данных за короткое время. Конвертер также может использоваться для получения актуальной информации о радиационных уровнях в космосе, что является важным для защиты космических аппаратов и экипажа.
Fe5 является частью более крупных систем, которые используются в космической технологии, и его функции варьируют в зависимости от конкретного приложения. Конвертер также может использоваться в других отраслях, где требуется передача данных на высоких частотах, например, в телекоммуникациях.
В целом, Fe5 является важной технологией, которая обеспечивает эффективную передачу данных и защиту космических объектов. Его использование продолжит развиваться, по мере того как мы продвигаемся в космической эксплорации и технологии связи
Классификация ферритов
Ферриты подразделяются на 3 основных класса:
- Железные сплавы с гарантированными потерями и высокой магнитной проницаемостью.
- Материалы с гистерезисом (зависимости намагниченности от напряжений внешнего поля) в виде прямоугольной петли.
- Модификации железа с уникальными свойствами.
В зависимости от основных параметров металла были созданы марки ферритов:
- 2000 H: никель-цинковый феррит с магнитной проницаемостью 2000 Гн/м;
- 100 ВНП: железный сплав с магнитной проницаемостью 100 Гн/м, состоящий из никеля, цинка и меди;
- 6000 HM1: материал из магния и цинка, магнитная проницаемость составляет 6000 Гн/м;
- 300 П: железная модификация с магнитной проницаемостью 300 Гн/м, состоящий из магния, марганца и калия.
В соответствии с марками металлов была создана классификация ферритов, демонстрирующая виды применения данной модификации железа:
- Общепромышленные: отличаются высокой магнитной проницаемостью и применяются при частоте до 25 МГц. При его изготовлении применяют чистый феррит, представляющий собой частицы ферритовой пыли. Используются в большинстве отраслей радиоэлектроники.
- Термостойкие: металлы с устойчивой магнитной проницаемостью, не изменяющейся при резком перепаде температур. Они используются при производстве антенных и сердечников.
- Высокопроницаемые: благодаря повышенной магнитной проницаемости, они применяются при низких частотах. Используются при изготовлении комплектующих для статических преобразователей.
Отдельные марки ферритов могут применяться для производства определенной аппаратуры. В ионных аккумуляторах может использоваться только феррит цинка, являющийся магнитомягким металлом. Для магнитных головок изготавливают железные сплавы на основе никель-цинковых материалов. При сборке датчиков и специальных детекторов используют ферриты с высокой термочувствительностью. Ферриты, способные работать при импульсном намагничивании, используются во время производства трансформаторов. Модификации железа, имеющие низкие потери при частоте, могут применяться в телевизионных приборах.
Правила хранения и утилизации LiFePo4

Перед тем как отправить LFP на продолжительное хранение, зарядите его до 40-60% и поддерживайте такой уровень на протяжении всего срока хранения. Аккумулятор следует держать в сухом месте, где температурный режим не опускается ниже комнатных показателей.
Когда ваша аккумуляторная батарея полностью отработает своё, следует обратиться в специальную организацию, занимающуюся утилизацией подобного оборудования. Если вы поступите подобным образом, то можете даже заработать на этом. Но в то же время, если вы просто выбросите источник энергии LFP на свалку, ничего страшного не будет.
Заключение
Чтобы вам легче было усвоить всю информацию изложенную в статье, я приведу далее несколько пунктов, которые нужно обязательно запомнить:
1. Следите за тем, чтобы напряжение LiFePo4 не опускалось ниже 2 V и не заходило за отметку 3,7 V. Что касается идеального диапазона, то это 2,5-3,65 V.
2. Если будете собирать батарею LFP самостоятельно, не забудьте про BMS.
3. Если используете АКБ в буферном режиме, понизьте её напряжение. Рекомендуемые параметры — 3,4-3,45 V.
4. Заряжать LFP нужно специальной зарядкой.
5. Перед самостоятельной сборкой электронакопителя, отбалансируйте ячейки, чтобы выровнять напряжение.
Основные преимущества LFP:
1. Продолжительный срок эксплуатации — 2000-7000 циклов заряда/разряда. При этом потеря ёмкости составляет 20%.
2. Срок хранения — 12-15 лет.
3. Может работать при широком диапазоне температур — -30…+60 градусов. Из этого можно сделать простой вывод: LFP хорошо подходят для использования зимой.
4. Не воспламеняется при повреждении компонентов.
5. Устойчивость к переразряду.
Естественно, не обошлось и без недостатков: это бОльшая по сравнению с Li-ion масса и себестоимость. LFP аккумуляторами уже можно обзавестись на AliexPress.
Современные символы, коды и сокращения[править | править код]
Таблица Менделеева в массовой культуре
В данном разделе в виде таблицы приводятся:
- атомный номер химического элемента;
- его наименование на русском языке и на латыни;
- его символ;
- период и группа в Периодической системе химических элементов
- регистрационный номер CAS;
- сокращения, используемые в российской металлургии при маркировке компонентов в составе сплавов цветных и чёрных металлов.
Цвета строк таблицы соответствуют следующим семействам химических элементов:
- Щелочные металлы
- Щёлочноземельные металлы
- Переходные металлы
- Металлы
- Полуметаллы
- Неметаллы
- Галогены
- Благородные газы
- Лантаноиды
- Актиноиды
| Химические элементы | Одноимённые простые вещества | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Атомныйномер | Названиена руccком языке | Названиена латыни | Символ | Период | Группа | Формула | CAS-номер | в составецветных металлов | в составечёрных металлов |
| 1 | Водород | Hydrogenium | H | 1 | 1 | H2 | — | — | |
| 2 | Гелий | Helium | He | 1 | 18 | He | — | — | |
| 3 | Литий | Lithium | Li | 2 | 1 | Li | Лэ (?) | — | |
| 4 | Бериллий | Beryllium | Be | 2 | 2 | Be | — | Л | |
| 5 | Бор | Borum | B | 2 | 13 | B | — | Р | |
| 6 | Углерод | Carboneum | C | 2 | 14 | C | — | У | |
| 7 | Азот | Nitrogenium | N | 2 | 15 | N2 | — | А | |
| 8 | Кислород | Oxygenium | O | 2 | 16 | O2 | — | — | |
| 9 | Фтор | Fluorum | F | 2 | 17 | F2 | — | — | |
| 10 | Неон | Neon | Ne | 2 | 18 | Ne | — | — | |
| 11 | Натрий | Natrium | Na | 3 | 1 | Na | — | — | |
| 12 | Магний | Magnesium | Mg | 3 | 2 | Mg | Мг | Ш | |
| 13 | Алюминий | Aluminium | Al | 3 | 13 | Al | А | Ю | |
| 14 | Кремний | Silicium | Si | 3 | 14 | Si | К (Кр) | С | |
| 15 | Фосфор | Phosphorus | P | 3 | 15 | P | — | — | |
| 16 | Сера | Sulfur | S | 3 | 16 | S | Ф | П | |
| 17 | Хлор | Chlorum | Cl | 3 | 17 | Cl2 | — | — | |
| 18 | Аргон | Argon | Ar | 3 | 18 | Ar | — | — | |
| 19 | Калий | Kalium | K | 4 | 1 | K | — | — | |
| 20 | Кальций | Calcium | Ca | 4 | 2 | Ca | — | — | |
| 21 | Скандий | Scandium | Sc | 4 | 3 | Sc | Скм (?) | — | |
| 22 | Титан | Titanium | Ti | 4 | 4 | Ti | Тпд (?) | Т | |
| 23 | Ванадий | Vanadium | V | 4 | 5 | V | Ва (?) | Ф | |
| 24 | Хром | Chromium | Cr | 4 | 6 | Cr | Х (Хр) | Х | |
| 25 | Марганец | Manganum | Mn | 4 | 7 | Mn | Мц (Мр) | Г | |
| 26 | Железо | Ferrum | Fe | 4 | 8 | Fe | Ж | — | |
| 27 | Кобальт | Cobaltum | Co | 4 | 9 | Co | К | К | |
| 28 | Никель | Niccolum | Ni | 4 | 10 | Ni | Н | Н | |
| 29 | Медь | Cuprum | Cu | 4 | 11 | Cu | М | Д | |
| 30 | Цинк | Zincum | Zn | 4 | 12 | Zn | Ц | — | |
| 31 | Галлий | Gallium | Ga | 4 | 13 | Ga | Ги | Ги | |
| 32 | Германий | Germanium | Ge | 4 | 14 | Ge | Г | — | |
| 33 | Мышьяк | Arsenicum | As | 4 | 15 | As | — | — | |
| 34 | Селен | Selenium | Se | 4 | 16 | Se | Ст (?) | Е | |
| 35 | Бром | Bromum | Br | 4 | 17 | Br2 | — | — | |
| 36 | Криптон | Krypton | Kr | 4 | 18 | Kr | — | — | |
| 37 | Рубидий | Rubidium | Rb | 5 | 1 | Rb | — | — | |
| 38 | Стронций | Strontium | Sr | 5 | 2 | Sr | — | — | |
| 39 | Иттрий | Yttrium | Y | 5 | 3 | Y | Им (?) | — | |
| 40 | Цирконий | Zirconium | Zr | 5 | 4 | Zr | Цэв (?) | Ц | |
| 41 | Ниобий | Niobium | Nb | 5 | 5 | Nb | Нп (?) | Б | |
| 42 | Молибден | Molybdenum | Mo | 5 | 6 | Mo | — | М | |
| 43 | Технеций | Technetium | Tc | 5 | 7 | Tc | — | — | |
| 44 | Рутений | Ruthenium | Ru | 5 | 8 | Ru | Ру | — | |
| 45 | Родий | Rhodium | Rh | 5 | 9 | Rh | Рд | — | |
| 46 | Палладий | Palladium | Pd | 5 | 10 | Pd | Пд | — | |
| 47 | Серебро | Argentum | Ag | 5 | 11 | Ag | Ср | — | |
| 48 | Кадмий | Cadmium | Cd | 5 | 12 | Cd | Кд | Кд | |
| 49 | Индий | Indium | In | 5 | 13 | In | Ин | — | |
| 50 | Олово | Stannum | Sn | 5 | 14 | Sn | О | — | |
| 51 | Сурьма | Stibium | Sb | 5 | 15 | Sb | Су | — | |
| 52 | Теллур | Tellurium | Te | 5 | 16 | Te | Т | — | |
| 53 | Иод | Iodum | I | 5 | 17 | I2 | — | — | |
| 54 | Ксенон | Xenon | Xe | 5 | 18 | Xe | — | — | |
| 55 | Цезий | Caesium | Cs | 6 | 1 | Cs | — | — | |
| 56 | Барий | Barium | Ba | 6 | 2 | Ba | Бр | — | |
| 57 | Лантан | Lanthanum | La | 6 | * | La | Ла | — | |
| 58 | Церий | Cerium | Ce | 6 | * | Ce | Се (?) | — | |
| 59 | Празеодим | Praseodymium | Pr | 6 | * | Pr | Пр | — | |
| 60 | Неодим | Neodymium | Nd | 6 | * | Nd | Нм | — | |
| 61 | Прометий | Promethium | Pm | 6 | * | Pm | — | — | |
| 62 | Самарий | Samarium | Sm | 6 | * | Sm | Сам (?) | — | |
| 63 | Европий | Europium | Eu | 6 | * | Eu | Ев | — | |
| 64 | Гадолиний | Gadolinium | Gd | 6 | * | Gd | Гн | — | |
| 65 | Тербий | Terbium | Tb | 6 | * | Tb | Том (?) | — | |
| 66 | Диспрозий | Dysprosium | Dy | 6 | * | Dy | Дим (?) | — | |
| 67 | Гольмий | Holmium | Ho | 6 | * | Ho | Гом (?) | — | |
| 68 | Эрбий | Erbium | Er | 6 | * | Er | Эрм (?) | — | |
| 69 | Тулий | Thulium | Tm | 6 | * | Tm | Тум (?) | — | |
| 70 | Иттербий | Ytterbium | Yb | 6 | * | Yb | Итн (?) | — | |
| 71 | Лютеций | Lutetium | Lu | 6 | * | Lu | Люн (?) | — | |
| 72 | Гафний | Hafnium | Hf | 6 | 4 | Hf | Гф | — | |
| 73 | Тантал | Tantalum | Ta | 6 | 5 | Ta | Тт (?) | — | |
| 74 | Вольфрам | Wolframium | W | 6 | 6 | W | — | В | |
| 75 | Рений | Rhenium | Re | 6 | 7 | Re | Ре | — | |
| 76 | Осмий | Osmium | Os | 6 | 8 | Os | Ос | — | |
| 77 | Иридий | Iridium | Ir | 6 | 9 | Ir | И | — | |
| 78 | Платина | Platinum | Pt | 6 | 10 | Pt | Пл | — | |
| 79 | Золото | Aurum | Au | 6 | 11 | Au | Зл | — | |
| 80 | Ртуть | Hydrargyrum | Hg | 6 | 12 | Hg | Р | — | |
| 81 | Таллий | Thallium | Tl | 6 | 13 | Tl | Тл | — | |
| 82 | Свинец | Plumbum | Pb | 6 | 14 | Pb | С | — | |
| 83 | Висмут | Bismuthum | Bi | 6 | 15 | Bi | Ви | Ви | |
| 84 | Полоний | Polonium | Po | 6 | 16 | Po | — | — | |
| 85 | Астат | Astatium | At | 6 | 17 | — | — | — | — |
| 86 | Радон | Radon | Rn | 6 | 18 | Rn | — | — | |
| 87 | Франций | Francium | Fr | 7 | 1 | Fr | — | — | |
| 88 | Радий | Radium | Ra | 7 | 2 | Ra | — | — | |
| 89 | Актиний | Actinium | Ac | 7 | ** | Ac | — | — | |
| 90 | Торий | Thorium | Th | 7 | ** | Th | — | — | |
| 91 | Протактиний | Protactinium | Pa | 7 | ** | Pa | — | — | |
| 92 | Уран | Uranium | U | 7 | ** | U | — | — | |
| 93 | Нептуний | Neptunium | Np | 7 | ** | Np | — | — | |
| 94 | Плутоний | Plutonium | Pu | 7 | ** | Pu | — | — | |
| 95 | Америций | Americium | Am | 7 | ** | Am | — | — | |
| 96 | Кюрий | Curium | Cm | 7 | ** | Cm | — | — | |
| 97 | Берклий | Berkelium | Bk | 7 | ** | Bk | — | — | |
| 98 | Калифорний | Californium | Cf | 7 | ** | Cf | — | — | |
| 99 | Эйнштейний | Einsteinium | Es | 7 | ** | Es | — | — | |
| 100 | Фермий | Fermium | Fm | 7 | ** | Fm | — | — | |
| 101 | Менделевий | Mendelevium | Md | 7 | ** | Md | — | — | |
| 102 | Нобелий | Nobelium | No | 7 | ** | No | — | — | |
| 103 | Лоуренсий | Lawrencium | Lr | 7 | ** | Lr | — | — | |
| 104 | Резерфордий | Rutherfordium | Rf | 7 | 4 | — | — | — | |
| 105 | Дубний | Dubnium | Db | 7 | 5 | — | — | — | |
| 106 | Сиборгий | Seaborgium | Sg | 7 | 6 | — | — | — | |
| 107 | Борий | Bohrium | Bh | 7 | 7 | — | — | — | |
| 108 | Хассий | Hassium | Hs | 7 | 8 | — | — | — | |
| 109 | Мейтнерий | Meitnerium | Mt | 7 | 9 | — | — | — | |
| 110 | Дармштадтий | Darmstadtium | Ds | 7 | 10 | — | — | — | |
| 111 | Рентгений | Roentgenium | Rg | 7 | 11 | — | — | — | |
| 112 | Коперниций | Copernicium | Cn | 7 | 12 | — | — | — | |
| 113 | Нихоний | Nihonium | Nh | 7 | 13 | — | — | — | |
| 114 | Флеровий | Flerovium | Fl | 7 | 14 | — | — | — | |
| 115 | Московий | Moscovium | Mc | 7 | 15 | — | — | — | |
| 116 | Ливерморий | Livermorium | Lv | 7 | 16 | — | — | — | |
| 117 | Теннессин | Tennessium/Tennessinum? | Ts | 7 | 17 | — | — | — | |
| 118 | Оганесон | Oganeson | Og | 7 | 18 | — | — | — |
- ↑ Благородные металлы — платиноиды
- ↑ Благородные металлы
- ↑ Лантаноиды
- ↑ Актиноиды
Получение
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
В печи углерод в виде кокса окисляется до монооксида углерода. Данный оксид образуется при горении в недостатке кислорода:
- 2C + O2 ⟶ 2CO↑
В свою очередь, монооксид углерода восстанавливает железо из руды. Чтобы данная реакция шла быстрее, нагретый угарный газ пропускают через Оксид железа(III):
- 3CO + Fe2O3 ⟶ 2Fe + 3CO2↑
Флюс добавляется для избавления от нежелательных примесей (в первую очередь от силикатов; например, кварц) в добываемой руде. Типичный флюс содержит известняк (карбонат кальция) и доломит (Карбонат магния). Для устранения других примесей используют другие флюсы.
Действие флюса (в данном случае карбонат кальция) заключается в том, что при его нагревании он разлагается до его оксида:
- CaCO3 →1000∘C CaO + CO2↑
Оксид кальция соединяется с диоксидом кремния, образуя шлак — метасиликат кальция:
- CaO + SiO2 →>1000∘C CaSiO3
Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности — это свойство позволяет разделять шлак от металла. Шлак затем может использоваться при строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит довольно много углерода (чугун). Кроме таких случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишки углерода и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используются и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо:
- Fe2O3 + 3H2 →1000∘C 2Fe + 3H2O,
при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах.
Химически чистое железо получается электролизом растворов его солей.
Что означает Fe5 и какое у него применение?
Термин Fe5 используется метеорологами для классификации силы ветра по шкале Фудзита, которая применяется для описания различных степеней разрушительности торнадо.
Fe5 соответствует категории Ф5 на шкале Фуджита и обозначает торнадо с экстремальной разрушительной мощью. Такие торнадо могут уничтожать дома, автомобили, и даже искусственные конструкции из железобетона.
Fe5 требует немедленного предупреждения и эвакуации людей из зоны, где он обнаружен. Специалисты стремятся предупредить о наступлении таких условий, чтобы люди могли принять меры безопасности и избежать серьезных повреждений или травм.
Fe5 – это мощное метеорологическое явление, которое требует всесторонней готовности и осторожности. Будьте бдительны и следуйте рекомендациям экспертов в случае приближения торнадо!
Особенности использования Fe5 в различных сферах
- Стойкость к высоким температурам и давлению: Fe5 обладает высокой термической стойкостью, что позволяет применять его в условиях высоких температур. Кроме того, Fe5 обладает высокой скоростью реакции, что позволяет использовать его в условиях высокого давления.
- Повышенная прочность и устойчивость к износу: Благодаря своей структуре и составу, Fe5 обладает высокой прочностью и устойчивостью к износу. Это делает его идеальным материалом для использования в производстве автомобилей, машин и других механизмов.
- Химическая стабильность: Fe5 обладает химической стабильностью, что позволяет использовать его в различных отраслях, связанных с химической промышленностью. Он не реагирует с большинством химических веществ, что делает его незаменимым материалом для производства химических реакторов и сосудов.
- Уникальные магнитные свойства: Одна из основных особенностей Fe5 заключается в его уникальных магнитных свойствах. Fe5 обладает высокой магнитной проницаемостью, что делает его отличным материалом для использования в электронике и магнитных приборах.
- Антикоррозионные свойства: Fe5 обладает отличными антикоррозионными свойствами, что делает его прекрасным материалом для использования в условиях высокой влажности и агрессивной среды. Он не подвержен коррозии и сохраняет свои свойства в течение длительного времени.
Благодаря всем своим особенностям, Fe5 находит широкое применение в различных сферах, включая металлургию, химическую промышленность, электронику, автомобильную и машиностроительную отрасли.
Железо в крови: общая информация
Все неорганические вещества в организме человека подразделяют на макро- и микроэлементы. К первым относятся кальций, натрий, калий и магний. Приставка «макро» говорит о сравнительно большом содержании этих элементов в организме.
Железо не образуется в организме и поступает только с пищей. Больше всего железа содержится в красном мясе, грибах, какао, бобовых, некоторых овощах и фруктах.
Железо относится к микроэлементам. Но несмотря на небольшое его количество, этот элемент играет важнейшую роль в поддержании жизнедеятельности организма. Нехватка или переизбыток железа отрицательно сказываются на состоянии здоровья, что выражается целым рядом симптомов и заболеваний.
К основным функциям железа относятся:
- Транспорт кислорода. Железо — составная часть пигмента гемоглобина, входящего в состав красных кровяных телец (эритроцитов) 1 . Благодаря железу гемоглобин способен переносить кислород из альвеол легких к остальным органам и тканям.
- Кроветворение. В костном мозге железо принимает участие в гемопоэзе — образовании клеток крови, в частности, эритроцитов.
- Детоксикация организма. Железо входит в состав ряда печеночных ферментов, принимающих участие в разрушении токсических веществ.
- Иммунитет. От уровня железа зависит и уровень лейкоцитов , а также их активность.
- Деление клетки. Железо входит в состав ферментов, принимающих участие в синтезе ДНК — процесса, необходимого для нормального деления клетки.
- Синтез гормонов. С участием железа происходит синтез гормонов щитовидной железы.
Железо, содержащееся в организме человека, бывает нескольких видов:
- Функциональное. Это железо, которое непосредственно задействовано во многих жизненных процессах. Например, железо, содержащееся в гемоглобине, обеспечивает транспорт кислорода от легких и до каждой клетки. Кроме того, этот микроэлемент содержится в миоглобине и некоторых жизненно важных ферментах.
- Транспортное. Это железо, которое циркулирует в крови. Отметим, что свободного железа в крови нет (поскольку оно токсично для тканей). Переносится железо в комплексе с белками-переносчиками. Это трансферрин, лактоферрин и мобилферрин 1 .
- Депонированное. В организме человека также имеются некоторые запасы железа. Главным образом, железо запасается в печени и селезенке в виде ферритина. Это сложный водорастворимый белковый комплекс. В меньшей степени железо откладывается в виде другого белка — гемосидерина, который образуется при разрушении гемоглобина.
- Свободное. В такой форме железо встречается внутри клеток. Из-за своей токсичности свободное железо перемещается внутри клетки не самостоятельно, а с помощью белка мобилферрина.
Около 75% всего железа в организме человека является гемовым. Оно содержится в гемоглобине, миоглобине и некоторых ферментах. Остальное, негемовое железо заключено в транспортные и депонированные белки.
Физические свойства фермия:
| 400 | Физические свойства | |
| 401 | Плотность | 9,7(1) г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – предположительно |
| 402 | Температура плавления | 1527 °C (1800 K, 2781 °F) – предположительно |
| 403 | Температура кипения | |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл) | |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип) | |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | |
| 411 | Молярный объём | |
| 412 | Теплопроводность | |
| 413 | Коэффициент теплового расширения | |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |
Fe5: что это такое?
Fe5 — это комплексное удобрение, содержащее основные макро- и микроэлементы, необходимые для полноценного развития растений. Название Fe5 произошло от основного вещества, которое входит в состав — пятиатомного железа (Fe5).
Комплексное удобрение Fe5 создано для повышения урожайности и качества сельскохозяйственной продукции. Оно содержит в себе не только железо, но и калий, магний, цинк, марганец, бор, медь, молибден, кобальт, а также необходимые дополнительные элементы.
Применение Fe5 позволяет улучшить общее состояние растений, увеличить их выносливость к неблагоприятным условиям, ускорить созревание и повысить содержание питательных веществ в растениях.
Fe5 широко используется в сельском хозяйстве, где его назначают для обработки зерновых, овощных, фруктовых и других культур. Он может быть использован как отдельное удобрение, так и в сочетании с другими.
Производство
Элюция: хроматографическое разделение Fm (100), Es (99), Cf, Bk, Cm и Am
Фермий производится бомбардировкой зажигалок. актиниды с участием нейтроны в ядерном реакторе. Фермий-257 — самый тяжелый изотоп, который получается путем захвата нейтронов, и его можно производить только в пикограммах. Основной источник — 85 МВт. Изотопный реактор с высоким потоком (HFIR) на Национальная лаборатория Окриджа в Теннесси, США, посвященная производству транскуриума (Z > 96) элементов. Изотопы фермия с меньшей массой доступны в больших количествах, хотя эти изотопы (254FM и 255Fm) сравнительно недолговечны. В «типичной кампании по переработке» в Ок-Ридже десятки граммов кюрий облучаются для получения количества дециграмм калифорний, миллиграммы количества берклий и эйнштейний, и пикограммы количества фермия. Однако нанограмм количества фермия могут быть приготовлены для конкретных экспериментов. Считается, что количество фермия, произведенного в результате термоядерных взрывов мощностью 20–200 килотонн, составляет порядка миллиграммов, хотя он смешан с огромным количеством обломков; 4,0 пикограмма 257Fm был извлечен из 10 килограммов обломков из «Хатч «испытание» (16 июля 1969 г.). Эксперимент Хатча произвел примерно 250 мкг 257Fm.
После производства фермий необходимо отделить от других актинидов и лантаноид продукты деления. Обычно это достигается ионообменная хроматография, со стандартным процессом с использованием катионита, такого как Dowex 50 или TEVA элюируют раствором α-гидроксиизобутирата аммония. Катионы меньшего размера образуют более стабильные комплексы с α-гидроксиизобутират-анионом и поэтому предпочтительно элюируются из колонки. Быстрый фракционная кристаллизация также был описан метод.
Хотя наиболее стабильным изотопом фермия является 257FM, с период полураспада 100,5 дней, большинство исследований проводится на 255Fm (т1/2 = 20,07 (7) часов), поскольку этот изотоп может быть легко выделен при необходимости в виде продукта распада 255Es (т1/2 = 39,8 (12) дней).
Слайд 2″Если бы в результате какой-то мировой катастрофы все накопленные научные знания
оказались бы уни-чтоженными, и к следующим поколениям людей пе-решла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, пе-редало бы наибольшую информацию? Я считаю, что это атомно-молекулярная теория: все тела состоят из атомов и молекул — маленьких частиц, которые находятся в постоянном движении, притягиваются друг к другу на небольшом расстоянии, но отталки-ваются, если их плотнее прижать друг к другу. В од-ной этой фразе содержится невероятное количество информации о мире, стоит лишь приложить к ней не-много воображения и чуть соображения.»Ричард Фейнман.

Происхождение названия
Праславянское *želězo (белор. жалеза, укр. залізо, ст.‑слав. желѣзо, болг. желязо, сербохорв. жељезо, польск. żelazo, чеш. železo, словен. železo) имеет ясные параллели в балтийских языках (лит. geležis, латыш. dzelzs). Слово является однокоренным словам «железа» и «желвак»; и имеет смысл «округлый камень, окатыш, блямба».
Имеется несколько версий дальнейшей этимологии этого балтославянского слова.
Одна из них связывает праслав. *želězo с греческим словом χαλκός, что означало железо и медь, согласно другой версии *želězo родственно словам *žely «черепаха» и *glazъ «скала», с общей семой «камень». Третья версия предполагает древнее заимствование из неизвестного языка.
Романские языки (итал. ferro, фр. fer, исп. hierro, порт. ferro, рум. fier) продолжают лат. ferrum. Латинское ferrum (< *ferzom), возможно, заимствовано из какого-то восточного языка, скорее всего, из финикийского. Ср. ивр. barzel, шумерск. barzal, ассирийск. parzilla. Отсюда же, вероятно, баскское burdina.
Германские языки заимствовали название железа (готск. eisarn, англ. iron, нем. Eisen, нидерл. ijzer, дат. jern, швед. järn) из кельтских.
Пракельтское слово *isarno- (> др.-ирл. iarn, др.-брет. hoiarn), вероятно, восходит к пра-и.е. *h1esh2r-no- «кровавый» с семантическим развитием «кровавый» > «красный» > «железо». Согласно другой гипотезе данное слово восходит к пра-и.е. *(H)ish2ro- «сильный, святой, обладающий сверхъестественной силой».
Древнегреческое слово σίδηρος, возможно, было заимствовано из того же источника, что и славянское, германское и балтийское слова для серебра.
Название природного карбоната железа (сидерита) происходит от лат. sidereus — звёздный; действительно, первое железо, попавшее в руки людям, было метеоритного происхождения. Возможно, это совпадение не случайно. В частности, древнегреческое слово сидерос (σίδηρος) для железа и латинское sidus, означающее «звезда», вероятно, имеют общее происхождение.






























