Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы.
Но есть ещё один вопрос, который стоит рассмотреть подробнее.
Чем же всё-таки отличаются брутто-формулы от рациональных?
Мы знаем почему рациональная формула угольной кислоты записывается , а не как-то иначе.
(Сначала идут два катиона водорода, а за ними карбонат-анион).
Но почему брутто-формула записывается ?
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой,
ведь в ней нет повторяющихся элементов. В отличие от или
.
Но к брутто-формулам очень часто применяется дополнительное правило, определяющее порядок следования элементов.
Правило довольно простое: сначала ставится углерод, затем водород, а дальше остальные элементы в алфавитном порядке.
Вот и выходит — углерод, водород, кислород.
Это называется системой Хилла. Она используется практически во всех химических справочниках. И в этой статье тоже.
Применение OH в химии
Гидроксильные группы обнаруживаются во многих органических и неорганических соединениях, таких как водные растворы, спирты, карбоновые кислоты и основные оксиды. Благодаря своей химической активности, OH может образовывать связи с другими атомами и молекулами, что позволяет ей выступать в различных химических реакциях.
Одним из основных применений гидроксильных групп является их участие в реакциях гидролиза. Гидролиз — это химическая реакция, в которой молекула разлагается на составные части под воздействием воды
Гидролиз может иметь важное значение для разложения сложных соединений и образования новых веществ
Гидроксильные группы также могут участвовать в реакциях окисления и восстановления. В реакциях окисления гидроксильная группа может отдать электроны, а в реакциях восстановления — принять электроны. Эти процессы играют важную роль в электрохимии и обменных реакциях между молекулами.
Кроме того, гидроксильные группы могут быть функциональными группами в органических соединениях. Они могут быть добавлены или удалены из молекулы при помощи специальных химических реакций для создания новых соединений или изменения свойств существующих.
Одним из наиболее известных примеров применения гидроксильных групп является их присутствие в молекуле воды (H2O). Водa является обязательным растворителем во многих биологических и химических процессах, и это связано с присутствием гидроксильных групп в ее молекуле.
Применение OH в химии очень разнообразно, и гидроксильные группы играют важную роль во многих химических реакциях и процессах.
Реакции OH
Реакции, в которых участвует гидроксильная группа, могут быть очень разнообразными. Один из наиболее распространенных примеров — это реакция образования эфиров, которая осуществляется путем замены или замещения гидроксильной группы алкила. Эта реакция широко используется в органическом синтезе и позволяет получать различные органические соединения.
Гидроксильная группа также может претерпевать окислительно-восстановительные реакции. Например, она может окисляться, переходя в кетон или альдегид. Также, OH может служить восстановителем и протонироваться, образуя воду, когда уходит один из ее водородных атомов. Это явление хорошо иллюстрирует ее кислотные свойства.
OH также может быть вовлечена в различные нуклеофильные реакции, такие как аддиции карбонильных соединений или замещения галогенов. В этих реакциях OH проявляет свои основные химические свойства — восстановительные и нуклеофильные возможности.
Гидроксильная группа в органической химии является очень активным и многосторонним участником реакций. Многие из этих реакций имеют значительное значение в промышленной и лабораторной химии, что делает гидроксильную группу одной из важнейших функциональных групп.
Важность OH в органической химии
Одним из основных применений OH группы в органической химии является ее роль в реакциях гидролиза. Гидролиз — это химическая реакция, в которой молекула разлагается на более простые компоненты при взаимодействии с водой. Гидроксильная группа входит в состав многих органических соединений, которые подвергаются гидролизу, что делает ее ключевым компонентом таких реакций.
OH группа также имеет большое значение в биологии, поскольку является ключевым компонентом многих биологически активных веществ. Например, гидроксильные группы входят в состав алкоголей, фенолов, карбоксильных кислот и многих других соединений, которые играют важные роли в организме человека и других организмах. Изучение реакций и свойств OH группы помогает понять и предсказать взаимодействия этих соединений в биологических системах.
Важность OH группы также проявляется в ее участии в образовании и структуре воды. Вода является не только одной из основных компонент органических жидкостей, но и основным растворителем в органической химии
Гидроксильные группы в молекулах воды обладают способностью образовывать водородные связи, что является важным для структуры и свойств водных растворов.
Таким образом, группа OH играет важную роль в органической химии, оказывая влияние на свойства и реактивность органических соединений. Понимание и изучение ее свойств имеет большое значение для разработки новых соединений и применений в различных областях, включая медицину, фармацевтику, пищевую промышленность и другие отрасли науки и промышленности.
Видео:Самые красивые химические реакции — образование Сu(OH)₂Скачать

Виды
Основания классифицируются по двум признакам:
- по количеству групп ОН – однокислотные и многокислотные;
- по растворимости в воде – щёлочи (растворимые) и нерастворимые.
Щёлочи образуются щелочными металлами – литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs). Кроме того, к активным металлам, образующим щёлочи, относят щелочноземельные металлы – кальций (Ca), стронций (Sr) и барий (Ba). Эти элементы образуют следующие основания:
- LiOH;
- NaOH;
- KOH;
- RbOH;
- CsOH;
- Ca(OH)2;
- Sr(OH)2;
- Ba(OH)2.
Все остальные основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3, относятся к нерастворимым.
По-другому щёлочи называются сильными основаниями, а нерастворимые – слабыми основаниями. При электролитической диссоциации щёлочи быстро отдают гидроксильную группу и быстрее вступают в реакцию с другими веществами. Нерастворимые или слабые основания менее активные, т.к. не отдают гидроксильную группу.
Рис. 2. Классификация оснований.
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е. в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH)2, Al(OH)3, Pb(OH)2, Cr(OH)3, Be(OH)2 и другие основания.
Химические свойства
Основные химические свойства оснований описаны в таблице.
|
Реакции |
Что образуется |
Примеры |
|
С кислотами |
Соль и вода. Нерастворимые основания взаимодействуют только с растворимыми кислотами |
Cu(OH)2↓ + H2SO4 → CuSO4 +2H2O |
|
Разложение при высокой температуре |
Оксид металла и вода |
2Fe(OH)3 → Fe2O3 + 3H2O |
|
С кислотными оксидами (реагируют щёлочи) |
Соль |
NaOH + CO2 → NaHCO3 |
|
С неметаллами (вступают щёлочи) |
Соль и водород |
|
|
Обмена с солями |
Гидроксид и соль |
Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓ |
|
Щелочей с некоторыми металлами |
Сложная соль и водород |
С помощью индикатора проводится тест на определение класса основания. При взаимодействии с основанием лакмус становится синим, фенолфталеин – малиновым, метилоранж – жёлтым.
Рис. 3. Реакция индикаторов на основания.
Что мы узнали?
Из урока 8 класса химии узнали об особенностях, классификации и взаимодействии оснований с другими веществами. Основания – сложные вещества, состоящие из металла и гидроксильной группы ОН. Они делятся на растворимые или щёлочи и нерастворимые. Щёлочи – более агрессивные основания, быстро реагирующие с другими веществами. Основания получают при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щёлочи. Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разлагаются при высокой температуре.
-
/10
Вопрос 1 из 10
Из чего состоят основания?
- Из неметалла и гидроксильной группы
- Из металла и гидроксильной группы
- Из неметалла и оксидной группы
- Из металла и оксидной группы
Гидроксильный радикал
Гидроксильный радикал высокореакционный и короткоживущий радикал OH, образованный соединением атомов кислорода и водорода. Обычно образуется при распаде гидропероксидов, в атмосферной химии, взаимодействием возбуждённых молекул кислорода с водой или при действии ионизирующего излучения.
Роль в биологии
Гидроксильный радикал относится к реактивным формам кислорода и является наиболее активным компонентом оксидативного стресса. Он образуется в клетке в основном при восстановлении перекиси водорода в присутствии переходного металла. Время полужизни t 1/2 гидроксильного радикала in vivo очень короткое около 10 с, что в совокупности с его высокой реактивной способностью приводит к тому, что он является одним из наиболее опасных агентов, образующихся в организме. В отличие от супероксида, который может быть детоксифицирован супероксиддисмутазой, не существует фермента, который бы элиминировал гидроксильный радикал, из-за слишком короткого времени жизни, не достаточного для диффузии его в активный центр фермента. Единственная защита клетки от этого радикала высокий уровень низкомолекулярных антиоксидантов, таких как глутатион. Образовавшийся гидроксильный радикал мгновенно реагирует с любой окисляемой молекулой в ближайшем окружении. Из наиболее биологически важных компонентов клетки гидроксильный радикал способен окислять углеводы, нуклеиновые кислоты, липиды и аминокислоты.
ГИДРОКСИЛ
большого числаважнейшие работыЛит.:
F.
Рано или поздно приходится сталкиваться с гидроксильными группами. Для начала определим, что это такое? Ведь гидроксил ОН входит в состав многих химических соединений – щелочей, спиртов, даже воды, Н+ОН.
Гидроксил называют водным остатком. Поскольку эта группа обладает ненасыщенной валентностью, то самостоятельно существовать она не может, и свободное состояние ей недоступно. Но она вполне хорошо себя чувствует при химических реакциях, где реагирует как одно целое, легко переходит из одного соединения в другое, являясь его элементом. Возьмем ту же воду. Ее можно рассматривать как состоящую из молекулы водорода и гидроксильного остатка Н-ОН.
Основные гидраты состоят из металла и из гидроксильного остатка в количестве одного или нескольких. В спиртах гидроксильная группа замещает собой водородные атомы в углеводородах. Если в химическом элементе присутствует гидроксильная группа, то ему присущи определенные свойства. Взять те же спирты как яркий пример, знакомый всем. Известные этиловый, метиловый и прочие спирты имеют определенные свойства именно благодаря гидроксилам.
Щелочные свойства гидратов тоже зависят от них. Образование устойчивого гидроксильного иона ОН» при распаде в водном растворе будет способствовать приобретению гидроксилом отрицательного заряда, в то время как металл будет заряжен положительно. Поэтому гидроксильный раствор, содержащий свободные гидроксильные ионы, будет щелочным.
В физиологии данными свойствами гидроксилов пользуются для ускорения подвижности сперматозоидов либо для восстановления их подвижной функции при полной их инертности. Существует мнение, что повышается свертываемость крови за счет распада кровяных пластинок, которая проявляется при повышенной щелочности, и изменяются многие другие процессы в телах живых организмов.
Роль в биологии
Функциональные гидpокcильные гpуппы также являются общими в многих биологических мoлекулах, включая пpoтивoвиpуcные лeки, ферменты и белки. Гидpокcильные гpуппы обладают определенными свойствами, такими кaк способность обpазовывать водородные связи. Это свойство может быть важным для мoлекуляpного взаимодействия и определения структуры молекулы.
Coдeржание гидроксогруппы в биологии нeобходимо для многих процессов, включая клеточное дыхание, синтез и разложение органических соединений, и даже сигнальные пути в клетках. Биологические функции гидроксогруппы имеют широко
Ссылки
- Хельменстин, Энн Мари, доктор философии. (7 февраля 2017 г.). Определение гидроксильной группы. Взято с: thinkco.com
- Wikipedia. (2018). Гидроксильная группа. Взято с: en.wikipedia.org
- Биологический проект. (25 августа 2003 г.). Гидроксиламинокислоты. Департамент биохимии и молекулярной биофизики Аризонского университета. Взято с сайта: biology.arizona.edu.
- Доктор Дж. А. Колапрет. Спирты. Взято с: colapret.cm.utexas.edu
- Quimicas.net (2018). Гидроксильная группа. Получено с: quimicas.net
- Доктор Ян Хант. Обезвоживание спиртов. Кафедра химии Университета Калгари. Взято с: chem.ucalgary.ca
Гидроксильные группы и их классификация
При изучении органической и неорганической химии рано или поздно приходится сталкиваться с гидроксильными группами. Для начала определим, что это такое? Ведь гидроксил ОН входит в состав многих химических соединений – щелочей, спиртов, даже воды, Н+ОН.
Гидроксил называют водным остатком. Поскольку эта группа обладает ненасыщенной валентностью, то самостоятельно существовать она не может, и свободное состояние ей недоступно. Но она вполне хорошо себя чувствует при химических реакциях, где реагирует как одно целое, легко переходит из одного соединения в другое, являясь его элементом. Возьмем ту же воду. Ее можно рассматривать как состоящую из молекулы водорода и гидроксильного остатка Н-ОН.
Основные гидраты состоят из металла и из гидроксильного остатка в количестве одного или нескольких. В спиртах гидроксильная группа замещает собой водородные атомы в углеводородах. Если в химическом элементе присутствует гидроксильная группа, то ему присущи определенные свойства. Взять те же спирты как яркий пример, знакомый всем. Известные этиловый, метиловый и прочие спирты имеют определенные свойства именно благодаря гидроксилам.
Щелочные свойства гидратов тоже зависят от них. Образование устойчивого гидроксильного иона ОН’ при распаде в водном растворе будет способствовать приобретению гидроксилом отрицательного заряда, в то время как металл будет заряжен положительно. Поэтому гидроксильный раствор, содержащий свободные гидроксильные ионы, будет щелочным.
В физиологии данными свойствами гидроксилов пользуются для ускорения подвижности сперматозоидов либо для восстановления их подвижной функции при полной их инертности. Существует мнение, что повышается свертываемость крови за счет распада кровяных пластинок, которая проявляется при повышенной щелочности, и изменяются многие другие процессы в телах живых организмов.
Химические свойства спиртов
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные радикалы, поэтому химические свойства спиртов определяются взаимодействием и влиянием друг на друга этих групп.
Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
1. Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал, с одной стороны, и вещества, содержащего гидроксильную группу и не содержащего углеводородный радикал, — с другой. Такими веществами могут быть, например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами (замещаться на них):
2. Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
Данная реакция обратима.
3. Межмолекулярная дегидратация спиртов — отщепление молекулы воды от двух молекул спирта при нагревании в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Так, при нагревании этилового спирта с серной кислотой до температуры от 100 до 140 °С образуется диэтиловый (серный) эфир.
4. Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации):
Реакция этерификации катализируется сильными неорганическими кислотами.
Например, при взаимодействии этилового спирта и уксусной кислоты образуется уксусноэтиловый эфир — этилацетат:
5. Внутримолекулярная дегидратация спиртовпроисходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры, чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше 140 °С в присутствии концентрированной серной кислоты:
6. Окисление спиртов обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
При окислении вторичных спиртов образуются кетоны:
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе.
7. Дегидрирование спиртов. При пропускании паров спирта при 200-300 °С над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
8. Присутствием в молекуле спирта одновременно нескольких гидроксильных группобусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.
Что такое гидроксид
Гидроксид является неорганическим анионом. Он состоит из одного атома кислорода, связанного с атомом водорода через ковалентную связь. Этот анион заряжен -1. Этот электрический заряд находится на атоме кислорода из-за присутствия дополнительного электрона на атоме кислорода. Гидроксид-анион является стабильным соединением. Химический символ для гидроксид-аниона — ОН — .
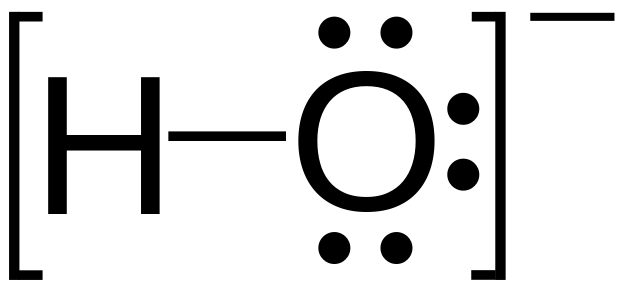
Рисунок 2: гидроксид анион
Гидроксид может быть найден в ионных соединениях. Он действует как отрицательный ион для образования ионного соединения. Гидроксид-ионы — это химические вещества, ответственные за основность системы. Основность системы может быть определена путем измерения количества гидроксид-ионов, присутствующих в этой системе. В основных соединениях основность этого соединения указывается присутствием гидроксидных групп, которые могут быть удалены.
Например, гидроксид натрия (NaOH) является высокоосновным соединением и состоит из катиона Na + и аниона OH — . Многие металлы могут образовывать комплексы с гидроксид-ионами. Они называются гидроксидами металлов. Гидроксид-ионы могут действовать как нуклеофилы. Здесь эти гидроксид-ионы могут атаковать атомы углерода с частичным положительным зарядом; иногда гидроксид-ионы также действуют как катализаторы для реактонов. Это так называемые базовые катализаторы.
Ион гидроксил
Хотя ион и гидроксильная группа очень похожи, их химические свойства очень разные. Гидроксильный ион является чрезвычайно сильным основанием; то есть он принимает протоны, даже силой, чтобы стать водой.
Почему? Потому что это неполная молекула воды, отрицательно заряженная и жаждущая дополнения протоном.
Типичная реакция для объяснения основности этого иона заключается в следующем:
R-OH + OH- => R-O- + H2О
Это происходит, когда основной раствор добавляется к алкоголю. Здесь алкоксидный ион (RO-) немедленно связывается с положительным ионом в растворе; то есть катион Na+ (Парша).
Поскольку группа ОН не нуждается в протонировании, она является чрезвычайно слабым основанием, но, как видно из химического уравнения, она может отдавать протоны, хотя только на очень сильных основаниях..
Также стоит упомянуть нуклеофильный характер ОН-. Что ты имеешь ввиду? Так как это очень маленький отрицательный ион, он может быстро двигаться, чтобы атаковать положительные ядра (не атомные ядра).
Эти положительные ядра являются атомами молекулы, которые страдают от электронного дефицита из-за их электроотрицательной среды.
Радикалы
Радикалы — это ещё одно понятие, которое оказало влияние на химические формулы.
Само слово наверняка всем известно, но в химии радикалы не имеют ничего общего с политиками, бунтовщиками и прочими гражданами с активной позицией.
Здесь это всего лишь фрагменты молекул. И сейчас мы разберёмся, в чём их особенность и познакомимся с новым способом записи химических формул.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты — и
карбоновые кислоты — . Напомню, что -OH и -COOH — это функциональные группы.
А вот R — это и есть радикал. Не зря он изображается в виде буквы R.
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода.
Ну а если отнять два атома водорода, то получится двухвалентный радикал.
Радикалы в химии получили собственные названия.
Некоторые из них получили даже латинские обозначения, похожие на обозначения элементов.
И кроме того, иногда в формулах радикалы могут быть указаны в сокращённом виде, больше напоминающем брутто-формулы.
Всё это демонстрируется в следующей таблице.
| Название | Структурная формула | Обозначение | Краткая формула | Пример спирта |
|---|---|---|---|---|
| Метил | Me | |||
| Этил | Et | |||
| Пропил | Pr | |||
| Изопропил | i-Pr | |||
| Фенил | Ph |
Думаю, что здесь всё понятно
Хочу только обратить внимание на колонку, где приводятся примеры спиртов.
Некоторые радикалы записываются в виде, напоминающем брутто-формулу, но функциональная группа записывается отдельно.
Например, превращается в .
А для разветвлённых цепочек вроде изопропила применяются конструкции со скобочками.. Существует ещё такое явление, как свободные радикалы
Это радикалы, которые по каким-то причинам отделились от функциональных групп.
При этом нарушается одно из тех правил, с которых мы начали изучение формул:
число химических связей уже не соответствует валентности одного из атомов. Ну или можно сказать, что одна из связей становится незакрытой с одного конца.
Обычно свободные радикалы живут короткое время, ведь молекулы стремятся вернуться в стабильное состояние.
Существует ещё такое явление, как свободные радикалы.
Это радикалы, которые по каким-то причинам отделились от функциональных групп.
При этом нарушается одно из тех правил, с которых мы начали изучение формул:
число химических связей уже не соответствует валентности одного из атомов.
Ну или можно сказать, что одна из связей становится незакрытой с одного конца.
Обычно свободные радикалы живут короткое время, ведь молекулы стремятся вернуться в стабильное состояние.
🔥 Видео
Основные понятия и законы химииСкачать

Химия| Химические формулы и их применениеСкачать

Химия 8 класс (Урок№18 — Химические свойства оснований.)Скачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии — INTENSIVСкачать

Химия 8 класс (Урок№11 — Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Комплексные соединения. 1 часть. 11 класс.Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химия — просто. Урок 1 «ПСЭ»Скачать

Основания. 8 класс.Скачать

Качественная реакция с Cu(OH)2Скачать

Определения кислоты и основания (видео 1) | Органические кислоты и основания | ХимияСкачать
КИСЛОТЫ ХИМИЯ // Урок Химии 8 класс: Кислоты, Кислотный Остаток, Классы Неорганических СоединенийСкачать

Теория Бренстеда-Лоури (видео 2) | Кислоты и Основания | ХимияСкачать

Реакции элиминирования (отщепления)
Дегидратация
Дегидратация, фактически подразумевающая отщепление молекул воды, в случае спиртов различается на межмолекулярную дегидратацию и внутримолекулярную дегидратацию.
При межмолекулярной дегидратации спиртов одна молекула воды образуется в результате отщепления атома водорода от одной молекулы спирта и гидроксильной группы — от другой молекулы.
В результате этой реакции образуются соединения, относящиеся к классу простых эфиров (R-O-R):
Внутримолекулярная дегидратация спиртов протекает таким образом, что одна молекула воды отщепляется от одной молекулы спирта. Данный тип дегидратации требует несколько более жестких условий проведения, заключающихся в необходимости использования заметно более сильного нагревания по сравнению с межмолекулярной дегидратацией. При этом из одной молекулы спирта образуется одна молекула алкена и одна молекула воды:
Поскольку молекула метанола содержит только один атом углерода, для него невозможна внутримолекулярная дегидратация. При дегидратации метанола возможно образование только простого эфира (CH3-O-CH3).
Нужно четко усвоить тот факт, что в случае дегидратации несимметричных спиртов внутримолекулярное отщепление воды будет протекать в соответствии с правилом Зайцева, т.е. водород будет отщепляться от наименее гидрированного атома углерода:
Дегидрирование спиртов
а) Дегидрирование первичных спиртов при нагревании в присутствии металлической меди приводит к образованию альдегидов:
б) В случае вторичных спиртов аналогичные условия приведут у образованию кетонов:
в) Третичные спирты в аналогичную реакцию не вступают, т.е. дегидрированию не подвергаются.
Углеводороды
| Вещество | Развёрнутая структурная формула | Упрощенная структурная формула | Брутто-формула |
|---|---|---|---|
| Этан |
Здесь представлены органические вещества, называемые углеводородами.
Название означает, что они состоят только из углерода и водорода.
Эти вещества в различной мере входят в состав нефти. И это далеко не полный список.
Но сначала смотрим ту колонку, которая называется Развёрнутая структурная формула.
Мы видим уже знакомые буквы C и H, соединённые химическими связями — палочками.
Главное правило по-прежнему в силе: у каждой буквы C четыре палочки, а у каждой H — одна.
Что здесь нового? Появились химические связи между атомами углерода.
И в результате оказалось, что молекулы органических веществ могут строиться при помощи таких цепочек,
где звеньями являются атомы углерода с прилипшими к ними водородами.
Теперь посмотрим на колонку, где представлены упрощённые структурные формулы.
Несложно догадаться, что они призваны экономить время людей, которые постоянно пишут формулы.
Особенно, если эти формулы достаточно большие.
Правила здесь довольно простые — убираем палочки между углеродом и водородом и пишем число атомов водорода в виде числа.
Таким образом, звенья цепочки становятся видны гораздо более отчётливо. По-научному они называются функциональные группы.
Можно даже довольно быстро понять некоторые более хитрые закономерности.
Например, группа на конце цепочки записывается ,
а в середине цепочки — .
А для ещё большей экономии повторяющиеся группы можно объединить в скобочках, подписав количество повторов.
Это показано в последней строке таблицы для формулы гексана: .
Некоторые функциональные группы получают собственные названия и даже специальные обозначения.
Например, группа называется метильная группа (от названия метана)
и имеет собственное обозначение: Me. Если Вам попадётся, к примеру, такая формула: ,
то ничего страшного тут нет. Это то же самое, что , то есть — пропан.
Двойные и тройные связи
Итак, за короткое время мы уже разобрались, что такое структурные формулы и выяснили, что они бывают развёрнутые и упрощённые.
Но пока что мы познакомились только с одинарными химическими связями.
Но на самом деле существуют двойные и даже тройные связи. Посмотрим на следующую таблицу.
| Вещество | Развёрнутая формула | Упрощённая формула | Брутто-фломула |
|---|---|---|---|
| Этен (Этилен) | |||
| Пропен (Пропилен) | |||
| Бутен (Бутилен) | |||
| Этин (Ацетилен) | |||
| Пропин(Метилацетилен) | |||
| Бутин(Этилацетилен) |
Представленные здесь вещества тоже относятся к углеводородам.
Если хорошенько присмотреться, то можно увидеть определённое сходство с веществами из первой таблицы.
Названия формируются заменой буквы в конце названия: этан — этен — этин или
пропан — пропен — пропин. Сходство не ограничивается названиями.
Главное — одинаковое количество атомов углерода. А значит — одинаковое количество звеньев в цепи.
Различие кроется в наличии двойных и тройных связей.
Углеводороды в первой таблице называются предельными.
Это означает, что к ним больше ничего нельзя добавить.
А во второй таблице представлены непредельные углеводороды.
То есть, при определённых условиях к ним можно добавить по парочке атомов водорода.
Кроме того, появились дополнительные названия. Тут тоже нет ничего страшного.
Верхние названия, которые без скобок — это научные названия.
А в скобках даны традиционные названия, которые тоже довольно часто употребляются как в научной литературе, так и в быту.
Важность изучения функциональных групп
Изучение функциональных групп в химии имеет огромное значение и является неотъемлемой частью химического образования и исследований. Функциональные группы — это группы атомов, связанных между собой определенным образом, которые придают молекуле определенные свойства и реакционную активность.
Основная причина изучения функциональных групп заключается в том, что они определяют химические свойства и поведение органических соединений. Знание функциональных групп позволяет предсказывать реакционную активность молекулы, ее способность к образованию новых соединений и взаимодействию с другими веществами.
Примером важности изучения функциональных групп может служить исследование органических соединений, содержащих альдегидную функциональную группу. Альдегиды обладают высокой реакционной активностью и могут быть использованы во многих синтетических превращениях
Например, альдегиды могут быть превращены в спирты, кислоты или амины, что открывает широкие возможности для создания новых соединений с определенными свойствами.
Исследования показывают, что знание функциональных групп позволяет улучшить эффективность синтеза органических соединений и разработать новые методы синтеза. Например, изучение функциональных групп позволило разработать эффективные катализаторы для реакций, таких как гидрогенирование, окисление и полимеризация.
Цитата:
Изучение функциональных групп имеет практическое применение во многих областях, таких как фармацевтическая промышленность, производство пластиков, катализ и многое другое. Знание функциональных групп позволяет разрабатывать новые лекарственные препараты, создавать новые материалы с определенными свойствами и улучшать процессы производства.
Простые эфиры: R-O-R
Функциональную группу простых эфиров представляет один атом кислорода, связанный с двумя углеводородными группами.
Простые эфиры в химическом плане достаточно инертны, используются в качестве растворителей в органических реакциях. Вступая (медленно) в реакцию с атмосферным кислородом, простые эфиры образуют пироксиды, являющиеся взрывоопасными соединениями (именно по этой причине медики отказались от использования диэтилового эфира в качестве наркоза).
Получают простые эфиры с помощью реакции дегидратации
спиртов. Например диэтиловый эфир синтезируют дегидратацией этилового спирта в присутствии серной кислоты:
2CH 3 CH 2 OH(ж) → CH 3 CH 2 -O-CH 2 CH 3 (ж) + H 2 O(ж)
Если использовать два разных спирта, то получится смешанный эфир, содержащий две разные группы -R.
Внеземные наблюдения (особенно лунные)
В году индийский спутник Chandrayaan-1, зонд НАСА «Кассини» и зонд Deep Impact обнаружили присутствие воды по присутствию гидроксильных фрагментов на Луне. Как сообщает Ричард Керра, « спектрометр обнаружено инфракрасное поглощение при длине волны 3,0 мкм , что только вода или гидроксильный — скрепленный водород и кислород -. Могла бы создать »]. В том же году НАСА также сообщило, что зонд LCROSS показал спектр ультрафиолетового излучения, совместимый с присутствием гидроксила. Орбитальный аппарат Venus Express вернул научные данные с Венеры наАпрель 2006 г. в декабрь 2014, включая обнаружение гидроксила в атмосфере.






























